2019年度塚原仲晃記念賞受賞者 高橋 琢哉 先生
「神経回路形成のメカニズムと臨床応用」
この度はこのような栄誉ある賞を頂くことになり、大変光栄に感じます。塚原仲晃先生のシナプス可塑性の素晴らしいご研究は今の私の研究の礎になっております。下に述べますように、私はシナプス可塑性のトランスレーショナルリサーチを行っています。このような私の研究のアプローチが日本神経科学会の皆様にも評価いただいたということを大変喜ばしく思うと同時に身の引き締まる思いもしております。
「基礎研究と臨床の死の谷を埋める」
これが私が大学院入学のころに自分の研究人生において掲げた目標でした。もともと基礎研究者になりたくて大学生のときに医学を学んでいましたが、その過程で精神神経疾患によって多くの人々の人生が制限されている一方で、なかなかその診断・治療法の開発が進まないことを知りました。その中で精神神経疾患に生物学的基盤を構築していくことの重要性を認識し、まず神経機能の生物学の研究に従事することにしました。医学生だったときに、当時東京大学医科学研究所にいらっしゃった御子柴克彦先生の研究室で神経生物学の研究に参加いたしました。その際、岡野栄之先生に直接実験の指導を受けました。手先が不器用で、実験に苦手意識がありましたが、岡野先生のご指導のおかげで実験がうまくいくという手ごたえを初めてつかむことができたと感じたことは今でもはっきり覚えています。御子柴先生の研究室では神経発生学の研究に参加させていただきました。第一線の研究に初めて触れた貴重な経験でした。また、御子柴先生の研究室は大変楽しい空間で、多くの素晴らしい先生方と知り合いになれたことは今でも私の宝だと思っています。
その後、様々な先生方のご支援で、米国のYale大学の大学院博士課程に進学することになりました。神経回路構築には活動非依存的な過程と活動依存的な過程が存在します。大学院生のときに神経活動非依存的な過程と考えられている神経軸索ガイダンスの分子メカニズムの研究に従事しました(Yale大学 Stephen M. Strittmatter博士)。私は神経軸索反発因子であるセマフォリンの受容体の研究を行いました。その研究でセマフォリン受容体の活性化機構を明らかにしました。Stritmmatter研究室は当時、独立した間もない時で、私は彼の最初の大学院生でした。今でこそ、巨大な研究室を運営するようになりましたが、当時は5-6人しかおらず、おかげで毎日彼と研究についてdiscussionをするという幸運にも恵まれました。Strittmatter先生は大変sharpな頭脳を持っており、簡単な実験、最小の労力で、重要な命題を短期間に解明しようとするplanningは大変勉強になりました。また当時セマフォリンの研究は非常に競争が厳しく、米国の研究スタイルを叩き込まれた院生時代でした。Strittmatter先生は非常に卓越した分子生物学者だと思います。
次に、博士研究員として、活動依存的なシナプス可塑性の研究を始めました (Cold Spring Harbor研究所 Roberto Malinow博士)。その研究で、げっ歯類の発育過程の体性感覚野において、外界からの感覚入力依存的(経験依存的)にグルタミン酸AMPA受容体がシナプスへ移行し、シナプス応答が変化することを見出しました。この研究において経験依存的AMPA受容体シナプス移行のin vivo評価系を確立しました。Malinow研究室は私が参画したときには、シナプス長期増強のメカニズムとしてAMPA受容体シナプス移行を発見したころで、飛ぶ鳥を落とす勢いでした。研究室の規模は10人ほどだったと思いますが、皆非常に優秀な研究者で大変勉強になりました。Malinow先生はイマジネーションが豊かな方で、面白い仮説を次々と考えつく発想力は大変印象的でした。トップの生理学者がどういうものかということを知ることができました。
初めはアメリカで自分の研究室を持とうと思っていましたが、いくつかの大学に面接に行ったときに、自分が目指しているサイエンスのスピード感や着地点があまりアメリカのサイエンスに合わないのではないかと思うに至りました。その中で、もう一度日本に育てて頂こうかと思っていたところ、ご縁があって横浜市立大学で自分の研究室を主催することになりました。独立初期の研究で海馬記憶形成にAMPA受容体シナプス移行が中核的役割を果たしていることを証明し、AMPA受容体シナプス移行が生体における脳の可塑的変化の分子基盤であることを明らかにしました。それに基づき、「基礎研究と臨床の死の谷を埋める」ということを目指した研究に着手しました。まず上述の「経験依存的AMPA受容体シナプス移行のin vivo評価系」を用いてAMPA受容体シナプス移行を促進する化合物、edonerpic maleateを特定しました(富士フイルムとの共同研究)。さらにそのターゲットタンパク質が偶然にもセマフォリンシグナル分子であるCRMP2であることが明らかにしました。それと並行して、脳機能損傷の代償機能発現の分子基盤の一つがAMPA受容体シナプス移行であることを見出しました。これから着想を得て、edonerpic maleateが脳損傷後の機能回復をリハビリテーション依存的に劇的に向上させることをげっ歯類と霊長類のカニクイザルで見出しました。リハビリテーションの効果を促進する薬剤はまだ世に出ておらず、現在脳卒中患者を対象として本化合物の臨床治験を行っています。また一方で、社会的隔離モデル動物におけるAMPA受容体シナプス移行の異常を見出し、多くの精神疾患の原因であると考えられている異常な養育環境が脳回路変容につながるシナプスレベルのメカニズムの一端を明らかにしました。この研究を機に、私はAMPA受容体を生きている精神神経疾患患者で観察する必要性を感じるようになりました。およそ10年の開発研究の末、AMPA受容体をヒト生体で可視化する世界初のポジトロン断層法(PET)プローブの開発に成功し、精神神経疾患、機能回復の根本原理解明を目指したヒト研究と実験動物を使った研究との融合研究を展開しております。本PET probeはリハビリテーション効果促進薬治験においても、「機能回復のバイオマーカー」として使われております。今後もこういった「基礎研究と臨床の死の谷を埋める」という目標を目指して研究を全力で推進していきたいと思います。また、私の研究は実際に患者さんの苦痛を軽減することにつながってこそ意味があるものになると思っております。そのためには、製薬会社含めて産業界のご協力も必要になってくると思っております。創薬の根本は科学であると思います。特に神経疾患の創薬は困難で、基礎研究者の力を結集して初めて可能になると思います。私も微力ながら基礎研究者と製薬会社ががっちりと協力した新薬開発体制構築を目指していきたいと思います。
研究に限った話ではないと思いますが、私は「出会い」が非常に重要だと思っています。人との出会いはもとより、分子、化合物、生命現象といった科学的事象との幸運な出会いが今の自分を作っていると思います。今まで私の研究に直接・間接的に関わってきた方々、また暖かいご支援をいただいている日本神経科学会の皆様にこの場を借りて御礼申し上げます。
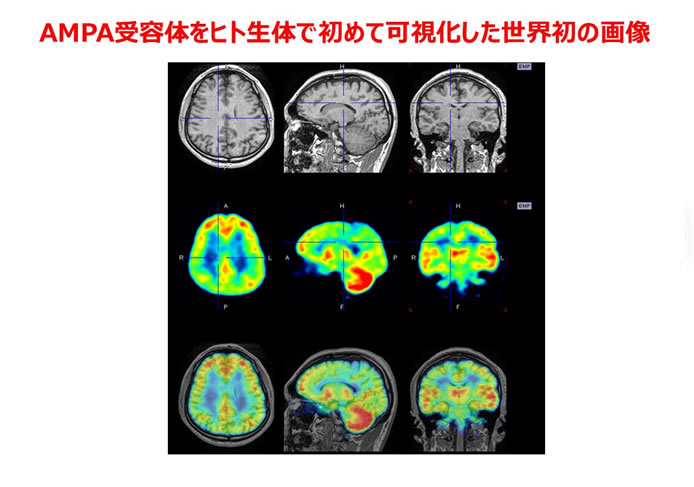
図 AMPA受容体PETプローブ([11C]K-2)を用いたfirst-in-humanテストの画像。
上段:MRI画像、中段:[11C]K-2画像、下段:MRI画像と[11C]K-2画像をmergeした画像。
経歴
1995年 慶應義塾大学医学部卒業
1995年―2000年 Yale大学大学院博士課程(Department of Biology)
2000年―2006年 Cold Spring Harbor研究所 postdoctoral fellow
2006年― 横浜市立大学大学院医学研究科 生理学 教授






