2024年度時実利彦記念賞受賞者 南部 篤 先生 受賞の言葉
大脳基底核が制御する運動機能と病態の解明、治療への応用
自然科学研究機構生理学研究所認知行動発達機構研究部門
南部 篤
南部 篤
日本の脳生理学の創始者のひとりであり、また学生時代に読んだ「脳の話」の著者である時実利彦先生の名を冠した賞を頂けることになり、感激しています。
私がまだ学部学生だった1970年台後半は、大脳基底核の変調によりパーキンソン病などの運動障害が引き起こされることから、大脳基底核が運動に重要な役割を果たしていることは明らかでしたが、その機能の詳細や大脳基底核疾患の病態についてはわからないことだらけでした。大学院の指導教官であった佐々木和夫先生から「大脳皮質や小脳はよくわかってきたので、よくわからない大脳基底核に取り組んでは?」と示唆を受け、私は大脳基底核の研究に携わるようになりました。
元々麻酔下での急性実験から始めたこともあり、覚醒下の慢性実験で行動中のサルから神経活動を記録する際にも電気刺激を用いました。まず、大脳基底核の出力核である淡蒼球内節からニューロン活動を記録し、大脳皮質を電気刺激してそのニューロンの反応を見ることで皮質からの入力を同定した後に、運動課題遂行中の活動を調べました。その際に、大脳皮質を電気刺激すると、淡蒼球内節ニューロンは早い興奮•抑制•遅い興奮からなる3相性の応答を示すことに気がつき、早い興奮は視床下核を経由しているのではないかと思っていました。
その後2年間、ニューヨーク大学で大脳基底核のスライス実験を行い、日本に戻ってから高田昌彦先生らとともに、サルの大脳皮質から視床下核への投射を、電気生理学と神経解剖学を組み合わせた手法で系統的に調べました。その結果、大脳皮質の一次運動野、補足運動野から視床下核へ体部位局在を保った投射があることがわかり、それまでよく知られていた線条体を介する直接路•間接路とは異なる新たな経路であることから、「ハイパー直接路」と名付けました。さらに、サルを用いて各神経経路を薬理学的にブロックしたところ、大脳皮質を刺激した際に淡蒼球内節で観察される早い興奮•抑制•遅い興奮が、それぞれハイパー直接路、直接路、間接路を介していることも分かりました。
このような神経経路は実際の運動の際にも働いていると考えることができます。大脳基底核からの出力である淡蒼球内節―視床投射は抑制性なので、大脳皮質が活動すると、①淡蒼球内節に最初に来るハイパー直接路を介する早い興奮は視床を抑制し、大脳皮質の現在の活動をリセットする、②次に来る直接路を介する抑制は視床を脱抑制し運動を引き起こす、③最後に来る間接路を介する遅い興奮は視床を抑制し引き起こされた運動をストップする、といった一連の神経活動の変動によって運動機能を制御すると考えられ、「動的活動モデル」を提唱しました。
一方、大脳基底核に不調をきたすとパーキンソン病やジストニアなどの大脳基底核疾患を生じますが、その病態生理をこの3相性の応答パターンの変化によって説明できるのではないかと考え、種々の疾患モデルを用いて実験を重ねました。それまで大脳基底核疾患の病態生理は、出力核の平均発射頻度の増減や、発射パターンの変化で論じられて来ましたが、平均発射頻度の変化は顕著なものではなく、発射パターンの変化で運動異常症の症状をうまく説明できるかは不明でした。
私たちはまず、パーキンソン病モデルサルより記録を行いました。ドーパミン神経毒であるMPTPをサルに投与すると、ヒトパーキンソン病と類似の症状を示します。そのようなパーキンソン病モデルサルの淡蒼球内節の神経活動を調べた結果、大脳皮質由来の抑制が減少していることが明らかになりました(図参照)。すなわち正常では視床を脱抑制することにより運動を引き起こしているが、パーキンソン病では抑制が減少したため運動遂行が困難になったと考えられます。
また、大脳基底核疾患には、パーキンソン病とは逆に運動が過剰になり不随意運動を示すジストニアがあります。ヒトの原因遺伝子を導入し異常タンパクを過剰発現させたジストニアモデルマウスから記録を行ったところ、淡蒼球内節において大脳皮質由来の抑制が増強していると同時に遅い興奮が減少していました(図参照)。すなわち抑制が過剰になったため、運動が引き起こされやすくなり、遅い興奮も減弱しているので運動のストップ機能も弱った結果、運動が過剰になり不随意運動に至ったと考えられます。
さらに進行期のパーキンソン病に対して、脳の一部を小さく壊したり、電極を埋め込み24時間電気刺激をするDBSのような脳外科的な治療法が有効です。同様に、パーキンソン病モデルサルの視床下核に薬剤を注入しブロックすると、淡蒼球内節における大脳皮質由来の抑制が回復するとともに症状も軽快しました(図参照)。すなわち抑制が回復したため、ふたたび運動を引き起こせるようになったと考えられます。
このように「動的活動モデル」は、種々の大脳基底核疾患の病態に加えて、定位脳手術などによって症状が改善する治療メカニズムをも示していると言えます。疾患によって変調を来した3相性の応答パターンを矯正する方法を考案できれば、新しい治療法の開発にも繋がると考えられ、今後はそれに向けて取り組んでいきたいと思います。
最後になりましたが、このような成果は一緒に研究を行った恩師、同僚、共同研究者、大学院生らのお陰であり、この場を借りて感謝を述べたいと思います。
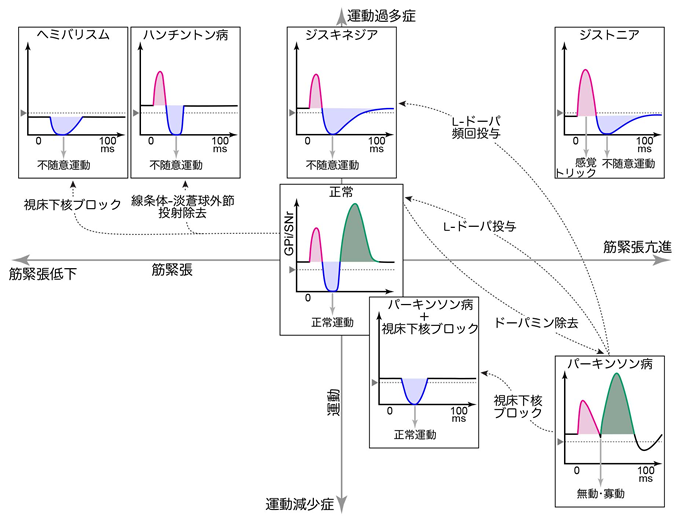
大脳基底核疾患の病態生理を説明する動的活動モデル
大脳皮質刺激によって誘発される淡蒼球内節•黒質網様部(GPi/SNr)の応答を、大脳基底核疾患の症状を特徴づける運動過多•運動減少(縦軸)と筋緊張の亢進•減少(横軸)を表す平面状にプロットしました。大脳皮質由来の応答が、種々の大脳基底核疾患において系統的に変化していることがわかります。
関連論文
- Nambu A et al. (1996) J Neurosci 16:2671
- Nambu A et al. (2000) J Neurophysiol 84:289
- Nambu A et al. (2002) Neurosci Res 43:111
- Chiken S et al. (2008) J Neurosci 28:13967
- Nishibayashi H et al. (2011) Mov Disord 26:469
- Sano H et al. (2013) J Neurosci 33:7583
- Chiken S et al. (2013) J Neurosci 33:2268
- Chiken S et al. (2015) Cereb Cortex 25:4885
- Koketsu D et al. (2021) J Neurosci 41:5502
- Chiken S et al. (2021) Cereb Cortex 31:5363
- Dwi Wahyu I et al. (2021) J Neurosci 41:2668
- Darbin O et al. (2022) Sci Rep 12:6493
- Hasegawa T et al. (2022) Nat Commun 13:2233
- Nambu A et al. (2023) Mov Disord 38:2145

南部 篤
自然科学研究機構生理学研究所認知行動発達機構研究部門
略歴
| 1984年 | 京都大学大学院博士課程医学研究科生理系専攻 中退 |
| 1985年 | 京都大学医学部 助手 |
| 1989年 | ニューヨーク大学医学部 博士研究員 |
| 1991年 | 生理学研究所 助教授 |
| 1995年 | 東京都神経科学総合研究所 副参事研究員 |
| 2002年 | 生理学研究所 教授 |
| 2023年 | 同 名誉教授•特任研究員 |
| 2024年 | 同 特別協力研究員 |





